|
Х И М И Я - 8
Проверочные работы
по теме: Первоначальные химические понятия
| |
|
П/р по теме "Уравнения реакций. Типы химических реакций"
1. Перепишите приведённые ниже схемы уравнений реакций, расставьте в них коэффициенты и укажите тип каждой реакции:
- CH4 → C + H2
- Zn + HCl → ZnCl2 + H2
- N2 + H2 → NH3
- P + O2 → P2O5
- KClO3 → KCl + O2
- Mg+ O2 → MgO
- CuSO4 + Fe → FeSO4 + Cu
- NO + O2 → NO2
|
- Al + S → Al2S3
- Fe + HCl → FeCl2 + H2
- H2O2 → H2O + O2
- CuCl2 + Mg → MgCl2 + Cu
- CaCO3 → CaO + CO2
- HgO → Hg + O2
- BaCO3 → BaO + CO2
- CO + O2 → CO2
|
2a. Составьте уравнения реакций разложения:
Оксида ртути(II)
Оксида платины(IV)
Оксида золота(III)
Оксида серебра
2b. Составьте уравнения реакций соединения:
Магния с серой
Серебра с серой
Натрия с серой
Цинка с серой
3. Из приведённых схем уравнений реакций выпишите те, которые относят к реакциям: а) соединения; б) замещения; в)разложения. Вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты.
- Р + ? → Р2О5
- H2O → ? + O2
- NaI + ? → I2 + NaCl
- HBr + Zn → ZnBr2 + ?
- Cu + ? → CuO
- AgCl → ? + Cl2
- KBr + Cl2 → ? + KCl
- HBr → Br2 + ?
|
- ? + Br2 → FeBr3
- N2 + ? → NO
- C6H6 + ? → CO2 + H2O
- Fe2O3 + H2 → H2O + ?
- P + S → P2S5
- NH3 → ? + H2
- SiO2 + Mg → ? + MgO
- ? + N2 → Ca3N2
|
|
| |
|
К/р №1 по теме "Первоначальные химические понятия"
Демонстрационный вариант
1. Перепишите приведённые ниже схемы реакций, поставьте в них коэффициенты и укажите тип каждой реакции.
а) Zn + O2 → ZnO
б) Mg + HCl → MgCl2 + H2
в) Au2O3 → Au + O2
г) Al + HCl → AlCl3 + H2
д) CO + O2 → CO2
2. Перепишите приведённые ниже формулы веществ и обозначьте над символами валентность элементов: Fe2O3; AgCl; NH3; SO2; CH4; CrO3; CuO. Напишите графические формулы данных веществ.
3. Вычислите массовые доли элементов в сульфиде меди(I) Cu2S.
4. Сколько граммов меди может восстановить алюминий массой 27 г?
CuCl2 + Al > Cu + AlCl3
5. Что обозначают записи: Cl2, S, 4N, 4CuO, H2, 4O2?
Для повторения пройдите тесты:
№3
№4 |
| |
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
Проверочные работы
по теме: Кислород
|
|
П/р по теме "Химические свойства
кислорода"
Закончить уравнения реакций:
| P + O2 → |
Cu + O2 → |
ZnS + O2 → |
| C + O2 → |
Al + O2 → |
SiH4 + O2 → |
| S + O2 → |
Ag + O2 → |
PH3 + O2 → |
| H2 + O2 → |
Mg + O2 → |
CuS + O2 → |
| Na + O2 → |
|
CH4 + O2 → |
| Ba + O2 → |
H2S + O2 → |
CS2 + O2 → |
| Ca + O2 → |
C4H10 + O2 → |
|
|
|
|
П/р по теме "Химические свойства водорода"
Напишите
уравнения реакций взаимодействия перечисленных ниже веществ с
водородом. Назовите три вещества, являющихся продуктами реакции
соединения.
Азот,
барий, бром, йод, калий, кальций, кислород, кремний, магний,
натрий, оксид вольфрама(VI), оксид железа(II), оксид железа(III),
оксид меди(II), оксид ртути(II), сера, углерод, фосфор, фтор,
хлор.
Помощь
|
|
|
П/р по теме "Массовая доля вещества в растворе"
Задачи для подготовки: (.doc)
- В 180 г воды растворили 20 г хлорида калия. Определите массовую долю хлорида калия в растворе.
- В 400 г воды растворили 70,5 г соли. Определите массовую долю соли в растворе.
- В 20 г воды растворили 1,5 г кислоты. Определите массовую долю кислоты в растворе.
- Определите массу раствора, в котором содержится 7 г хлорида натрия, массовая доля которого составляет 2,5%.
- Определите массу раствора, в котором содержится 600 г гидроксида натрия, массовая доля которого составляет 20%.
- Определите массу раствора, в котором содержится 12 г нитрата натрия, массовая доля которого составляет 8%.
- Рассчитайте массы воды и нитрата калия, необходимые для приготовления 250 г 15%-ного раствора.
- Рассчитайте массы воды и хлорида натрия, необходимые для приготовления 150 г 6%-ного раствора.
- Рассчитайте массы воды и сульфата магния, необходимые для приготовления 340 г 9%-ного раствора.
- Вычислите массу хлороводорода, который необходимо растворить в 1270 г воды, чтобы получить 36,5%-ный раствор.
- Вычислите массу сульфата меди(II), который необходимо растворить в 270 г воды, чтобы получить 20%-ный раствор.
- Вычислите массу хлорида калия, который необходимо растворить в 180 г воды, чтобы получить 10%-ный раствор.
- В раствор гидроксида калия массой 120 г и массовой долей 6%, добавили 40 г воды. Определите массовую долю гидроксида калия в полученном растворе.
- В раствор хлорида бария массой 200 г и массовой долей 18%, добавили 160 г воды. Определите массовую долю хлорида бария в полученном растворе.
- В растворе гидроксида калия массой 160 г и массовой долей 10%, растворили ещё 20 г этого вещества. Определите массовую долю гидроксида калия в полученном растворе.
- В растворе серной кислоты массой 140 г и массовой долей 15%, растворили ещё 25 г этого вещества. Определите массовую долю серной кислоты в полученном растворе.
- В раствор нитрата калия массой 320 г и массовой долей 9%, добавили 35 г воды. Определите массовую долю нитрата калия в полученном растворе.
- В растворе хлорида натрия массой 120 г и массовой долей 6%, растворили ещё 18 г этого вещества. Определите массовую долю хлорида натрия в полученном растворе.
- Слили два раствора соли: 70 г 30%-ного и 210 г 10%-ного. Определите массовую долю соли в полученном растворе.
- Слили два раствора нитрата натрия: 160 г 15%-ного и 70 г 3%-ного. Определите массовую долю азотной кислоты в полученном растворе.
- Слили два раствора щёлочи: 80 г 20%-ного и 25 г 40%-ного. Определите массовую долю щёлочи в полученном растворе.
- Слили два раствора азотной кислоты: 120 г 40%-ного и 280 г 10%-ного. Определите массовую долю азотной кислоты в полученном растворе.
- Слили два раствора сахара: 230 г 8%-ного и 45 г 28%-ного. Определите массовую долю сахара в полученном растворе.
- Слили два раствора азотной кислоты: 200 г 12%-ного и 400 г 3%-ного. Определите массовую долю азотной кислоты в полученном растворе.
|
|
|
Контрольная работа по темам "Кислород", "Водород", "Растворы. Вода"
1. Нарисуйте схему прибора, с помощью которого можно получить и собрать в лаборатории
а) кислород методом вытеснения воздуха;
б) кислород методом вытеснения воды;
в) водород методом вытеснения воздуха;
г) водород методом вытеснения воды.
Сделайте подписи, указав вещества, используемые для получения газа, место их нахождения в приборе, где собирается полученный газ.
2. В одном столбще приведённых ниже таблиц перечислены (под номерами 1 - 5) важнейшие области применения кислорода (водорода). Во втором столбце таблицы буквами А - Е обозначены свойства кислорода (водорода), лежащие в основе его применения. Приведите в соответствие записи таблицы. (образец ответа: 1Б, 2Д и т.д.)
| Применение кислорода |
Свойства кислорода |
1. В технике для резки и сварки металлов.
2. В медицине для облегчения дыхания больных.
3. В металлургии (кислородное дутьё).
4. В химической промышленности для получения новых веществ.
5. В химических лабораториях для проведения реакций.
|
А. Поддерживает дыхание.
Б. Реагирует со многими простыми и сложными веществами, образуя оксиды.
В. В реакциях с кислородом создаются высокие температуры. Реакции экзотермичны.
Г. Ускоряет процесс горения и окисления веществ.
Д. Бесцветный газ, тяжелее воздуха.
Е. Газ, плохо растворимый в воде, сжижается под давлением. |
| Применение водорода |
Свойства водорода |
1. В металлургии для получения металлов
2. В технике для сварки и резки металлов
3. Топливо в двигателях
4. Синтез аммиака
5. В начале прошлого века для заполнения воздушных шаров и дирижаблей |
А. Газ легче воздуха.
Б. При нагревании и повышенном давлении реагирует с азотом.
В. Взаимодействует с хлором со взрывом.
Г. Восстанавливает металлы из их оксидов.
Д. Газ, плохо растворимый в воде, сжижается под давлением.
Е. Сгорает в кислороде с выделением большого количества энергии. |
3. Допишите уравнения химических реакций. Укажите тип реакций.
а) ...... + ...... = H2O
б) Fe + O2 = ......
в) ...... + HCl = AlCl3 + ......
г) Cu + ...... = CuO
д) CH4 + O2 = ...... + ......
е) CuO + ...... = Cu + ......
ж) ...... + O2 = SO2
з) CuS + ...... = SO2 + ......
и) ...... + H2SO4 = ZnSO4 + .......
к) WO3 + ...... = W + ......
л) H2 + ...... = HCl
м) Br2 + ...... = HBr
н) N2 + H2 = ......
о) ...... + H2O = H2SO4
п) SO2 + H2O = ......
p) H2 + ...... = NaH
c) Ca + ...... = CaH2
т) Na + ...... = NaOH + ......
у) ...... + H2O = Ca(OH)2
ф) ...... + HCl = ZnCl2 + ......
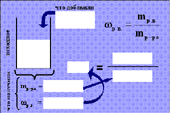
4. Запишите в соответствующие графы формулы для вычислений, выполните вычисления и заполните таблицу:
| Формула для вычисления |
|
|
|
|
| |
mводы |
mв-ва |
mр-ра |
wр.в. |
соль |
72 г |
18 г |
? |
? |
? |
? |
40 г |
8% |
? |
? |
200 г |
0,165 |
| Формула для вычисления |
|
|
|
|
| |
mводы |
mв-ва |
mр-ра |
wр.в. |
соль |
96 г |
24 г |
? |
? |
? |
? |
150 г |
14% |
? |
? |
340 г |
0,02 |
| Формула для вычисления |
|
|
|
|
| |
mводы |
mв-ва |
mр-ра |
wр.в. |
соль |
167 г |
33 г |
? |
? |
? |
? |
55 г |
15% |
? |
? |
200 г |
0,12 |
| Формула для вычисления |
|
|
|
|
| |
mводы |
mв-ва |
mр-ра |
wр.в. |
соль |
125 г |
25 г |
? |
? |
? |
? |
90 г |
0,22 |
? |
? |
80 г |
20% |
5. а) Используя термохимическое уравнение реакции
CuO + H2 = Cu + H2O + 80 кДж
рассчитайте количество теплоты, выделяющейся при восстановлении 5 моль оксида меди(II).
б) По термохимическому уравнению реакции
2H2S + 3O2 = 2SO2 + 2H2O + 857,3 кДж
вычислите, какое количество теплоты выделится при сжигании 3 моль сероводорода?
в) По термохимическому уравнению реакции
Si + O2 = SiO2 + 850,6 кДж
вычислите, какое количество теплоты может выделиться, если сжечь в кислороде 4 моль кремния.
г) По термохимическому уравнению реакции
2H2O = 2H2 + O2 - 484 кДж
рассчитайте количество теплоты, поглощённой при образовании 6 моль водорода.
|
|
|
Написать уравнения реакций между предложенными веществами, указать названия кислот и солей:
H2SO4 + Fe =
|
H2SO4 + Zn =
|
H3PO44 + Сa =
|
| HCl + Na = |
HCl + Al = |
HCl + Zn = |
| H3PO4 + Ba = |
H2SO4 + Na = |
HCl + Fe = |
HCl + MgO =
|
CaO + H2CO3 =
|
MgO + H3PO4 =
|
HCl + Na = |
K2O + H3PO4 = |
HNO3 + FeO = |
| H2SO4 + Fe2O3 = |
HNO3 + CuO = |
HCl + Al = |
| HNO3 + FeO = |
HCl + Al2O3 = |
Na2O + HCl = |
| H3PO4 + Na2O = |
H2SO4 + Mg = |
H2SO4 + MgO = |
HCl + Fe(OH)3 =
|
Al(OH)3 + H2SO4 =
|
HCl + CuO = |
| NaOH + HNO3 = |
HNO3 + FeO = |
KOH + H3PO4 = |
| Mg(OH)2 + HNO3 = |
HCl + Zn = |
HNO3 + Al(OH)3 = |
| H2SO4 + Zn = |
KOH + HCl = |
HCl + Al = |
| H2SO4 + Fe2O3 = |
H2SO4 + Zn(OH)2 = |
H2SO4 + Ba(OH)2 = |
|
|
2.04 |
Для подготовки к диктанту используйте презентацию
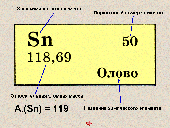
Диктант проводится с использованием периодической системы.
1. Напишите знаки трёх элементов, находящихся в периодической системе в малом (большом) периоде.
2. Напишите химические знаки пятого (первого, второго, ....) лантаноида (актиноида).
3. Напишите химические знаки щелочных металлов (галогенов, инертных элементов).
4. Сколько элементов находится в .... периоде?
5. Дайте характеристику положения элемента № ... в периодической системе.
6. Выпишите знаки элементов .... группы главной (побочной) подгруппы. |
|
|
Подготовка к контрольной работе
Часть А (тестовая) - приведены вопросы одного варианта
Часть С
1. Даны вещества:
а) цинк, раствор серной кислоты, оксид меди (II), вода, гидроксид кальция, оксид углерода(IV).
б) кальций, соляная кислота, вода, оксид кальция, медь, гидроксид натрия.
в) вода, соляная кислота, магний, гидроксид бария, гидроксид меди(II).
г) фосфор, оксид бария, раствор серной кислоты, гидроксид калия, оксид серы(VI), вода.
Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2.Напишите уравнения реакций, с помощью которых можно осуществить превращения:
а) FeO → FeSO4 → Fe(OH)2 → FeO → Fe → FeCl2
б) Cu
→ CuO → CuCl2 → Cu(OH)2 → CuO → Cu
в) C → CH4 → CO2 → Na2CO3→ CaCO3 → CO2
г) S → SO2 → SO3 → H2SO4 → ZnSO4 → Zn(OH)2
д) Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al(NO3)3
е) P → PH3 → P2O5 → H3PO4 → K3PO4 → Ag3PO4
ж) Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → Fe2O3 → Fe → FeCl2
Часть В
1. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит.
| 1) MgO |
11) Ca(OH)2 |
А.соль |
| 2) H3PO4 |
12) P2O5 |
Б. кислотный оксид |
| 3) Al(OH)3 |
13) CuO |
В. кислота |
| 4) NaOH |
14) HNO3 |
Г. нерастворимое основание |
| 5) CO2 |
15) SO3 |
Д. щёлочь |
| 6) Fe(OH)3 |
16) Zn(OH)2 |
Е. основный оксид |
| 7) CuSO4 |
17) FeO |
|
| 8) H2SO4 |
18) SO2 |
|
| 9) KOH |
19) Mg(NO3)2 |
|
| 10) NaCl |
20) Cu(OH)2 |
|
2. Вставьте в схемы уравнений химических реакций недостающие формулы веществ.
1) ... + KOH → Fe(OH)3 + ...
2) SO3 + ... → K2SO4 + ...
3) ... +... → Mg(NO3)2 + H2O
4) ... + ... BaSO4 → NaCl
5) HCl + ... → FeCl2 + H2
6) ... + ... → H2CO3
7) ... + ... → MgCl2 + H2
8) ... + ... → K3PO4 + H2O
9) ... + ... → Na2S + H2O
10) ... + ... → Ca(OH)2
11) ... + K3PO4 → ... + Ag3PO4
12) CuSO4 + ... → Na2SO4 +...
13) ... + ... → H2SO4
14) Na + ... → NaOH + ...
15) CO2 + ... → CaCO3 + ...
16) PH3 + ... → P2O5 + ...
3. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
| 1) NaOH + CO2 |
А. FeCl2 + H2 |
| 2) KOH + H3PO4 |
Б. FeCl3 + H2 |
| 3) NaOH + H2SO4 |
В. Fe2O3 + H2O |
| 4) SO2 + NaOH |
Г. K3PO4 + H2O |
| 5) HNO3 + CuO |
Д. MgSO4 + H2 |
| 6) Fe(OH)2 + HCl |
Е. Na2CO3 + H2O |
| 7) Mg + H2SO4 |
Ж. Cu(NO3)2 + H2O |
| 8) P2O5 + KOH |
З. FeCl2 + H2O |
| 9) Fe(OH)2 |
И. Na2SO3 + H2O |
| 10) SO3 + NaOH |
К. Na2SO4 + H2O |
| 11) Fe + HCl |
Л. FeO + H2O |
| 12) Fe(OH)3 |
М. FeCl3 + H2O |
|
| |
|
|
| |
|
|
|
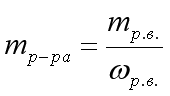

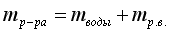
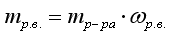
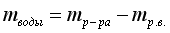
|

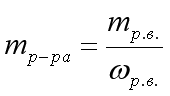

![]()
![]()
![]()



