
Тема 1. Первоначальные химические понятия
дата |
тема |
к чему стремиться |
к уроку |
домашнее задание |
12.10 |
Химические формулы. Относительная молекулярная масса | Основные понятия: химическая формула, качественный и количественный состав вещества, индекс, коэффициент, относительная молекулярная масса |
ХИМИЧЕСКАЯ ФОРМУЛА |
| Состав всех веществ химики
отражают в виде химических формул. Химическая формула - это условная запись состава вещества с помощью символов химических элементов и индексов. Символ химического элемента показывает один атом этого элемента. Индекс показывает число атомов данного химического элемента в молекуле и пишется в формуле после знака химического элемента внизу. |
состав
молекулы |
химическая
формула |
модель
молекулы |
прочтение
формулы |
| два атома водорода | H2 |
 |
"аш-два" |
| один атом калия, один атом кислорода и один атом водорода | KOH |
 |
"калий-о-аш" |
| один атом серы и три атома кислорода | SO3 |
 |
"эс-о-три" |
| два атома калия, один атом серы и четыре атома кислорода | K2SO4 |
 |
"калий-два-эс-о-четыре" |
Химическая формула показывает качественный (какие атомы) и количественный (сколько атомов каждого элемента) состав молекул. Коэффициент указывает на число свободных атомов химического элемента или число молекул вещества, записывается перед символом элемента или перед химической формулой. |
 |
 |
 |
семь атомов водорода |
четыре молекулы водорода |
три молекулы аммиака |
7H |
4H2 |
3NH3 |
"семь-аш" |
"четыре-аш-два" |
"три-эн-аш-три" |
ОТНОСИТЕЛЬНЫЕ АТОМНАЯ И МОЛЕКУЛЯРНАЯ МАССЫ
Размеры атомов и молекул очень малы. Естественно, что ничтожно малы и их массы. m(Н) = 0,000 000 000 000
000 000 000 001 674 г = 1,674 * 10-24 г Такими значениями пользоваться
неудобно, поэтому химики и физики используют относительные атомные и молекулярные массы. |
ОТНОСИТЕЛЬНЫЕ
АТОМНЫЕ МАССЫ |
|||
| Ar(H) = 1 | Ar(O) = 16 | ||
| Ar(Na) = 23 | Ar(S) = 32 | ||
| Ar(Cu) = 64 | Ar(Fe) = 56 | ||
| Ar(P) = 31 | Ar(Cl) = 35,5 | ||
ОТНОСИТЕЛЬНЫЕ
МОЛЕКУЛЯРНЫЕ МАССЫ |
||
| N2 | Mr(N2) = 2*14 = 28 | |
| H2O | Mr(H2O) = 2*1+ 16 = 18 | |
| SO3 |  |
Mr(SO3) = 32 + 3*16 = 80 |
| H2SO4 |  |
Mr(H2SO4) = 2*1 + 32 + 4*16 = 98 |
| Ca(OH)2 |  |
Mr(Ca(OH)2) = 40 + 2*(16 + 1) = 74 |
| Fe(NO3)2 |  |
Mr(Fe(NO3)2 = 56+2*(14+3*16) = 180 |
| Mg3(PO4)2 | 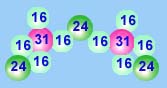 |
Mr(Mg3(PO4)2) = 3*24 + 2*(31 + 4*16) = 262 |
|
| темы уроков |
| тесты |





